II. Description du venin
1) Le venin
Le venin de serpent est un mélange complexe de protéines, dont la découverte c'est fait progressivement en fonction des avancées technologiques. Il est produit par les glandes présentes dans la tête du serpent.
Ce venin est obtenu par pression manuelle ou par stimulation électrique des glandes. Cependant des chercheurs, on réussit (grâce à la culture de cellules glandulaires) à fabriquer du venin artificiellement, par ailleurs certaine protéiques peuvent être synthétisées sous forme "recombinante par biologie moléculaire". Pour cela des gènes extraits directement des glandes venimeuses du serpent, sont alors mélangées avec des microorganismes.
Le venin est produit par un cycle que l’on appelle "cycle sécrétoire", il commence par une fabrication extrêmement rapide puis parvient progressivement à un "stade de plateau" (saturation des glandes). Ce stade de plateau est atteint en 2 à 3 semaines.
La quantité de venin injecté varie en fonction du serpent, de l'appétit de celui-ci, de sa taille, de sa morsure... etc. Il y a environ 10 à 50% de la capacité glandulaire qui est injectée lors la morsure.
Le venin est composé de nombreuses protéines, il est classique de les séparer en deux groupes :
- Les enzymes : ils sont généralement faibles en toxicité et également très aiguë.
- Les toxines : Elles sont le plus utilisées en pharmacologie, elles proviennent des venins de la famille des Elapidae et des Atraxtaspidae, dont leur toxicité et la plus importante, qui sont principalement employé dans l’industrie pharmaceutique.
2) Enzymes
Les enzymes sont des protéines dont le poids moléculaire est élevé. Les enzymes possèdent 2 propriétés catalytiques :
- Premièrement les enzymes n’ont aucune propriété immunologique au niveau de l'organisme receveur, il ne permet donc pas la synthèse d'anticorps spécifiques.
- Puis les effets toxicologiques de ces enzymes résultent du temps d’action et du nombre de ces derniers, c’est-à-dire que t’en qu’il y a des enzymes dans un organisme, les effets toxicologiques se répètent en boucle.
Remarque : Les vépiridae possèdent un venin extrêmement riche en enzyme.
Voici quelques enzymes présentent dans le venin de serpents :
- Phospholipases
 Phospholipases
Phospholipases
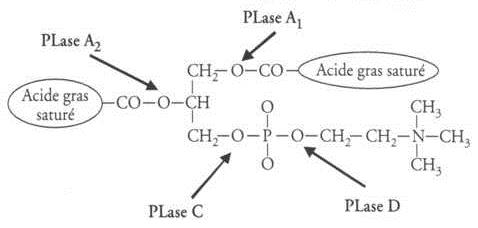
La majorité des venins de serpent compte des phospholipases, ils sont classés grâce à des lettres (A, B, C, D). Ces enzymes hydrolysent les phospholipides libres ou membranes en acide gras. Ici se sont les Phospholipases A2 qui sont très fréquent, elles sont responsables d’hémostase, de réaction inflammatoire… Son poids moléculaire est estimé à 8 kDa et peut s’élever à 36kDa lorsque qu’une polymérisation est produite.
- Acétylcholinestérase
 Acétylcholinestérase
Acétylcholinestérase
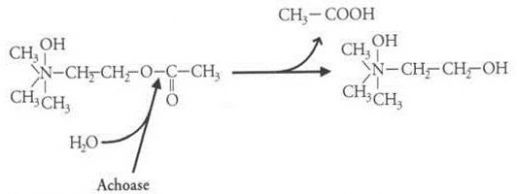
L’acétylcholinestérase (présente également chez l’Homme) est capable chez les Elapidae d’hydrolyser l’acétylcholine qui lui est le principale médiateur chimique de l’influx nerveux. Cette enzyme obtient un poids moléculaire de 126 kDa (composé de deux monomères de 63 kDa) et un pH qui peut varier entre 8 et 8.5. Pour finir l’acétylcholinestérase est l’une des enzymes agissant dans le venin neurotoxique.
- Phosphoestérases
 Phosphoestérases
Phosphoestérases
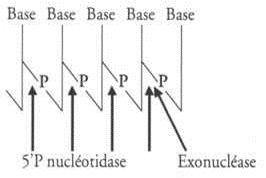
Que ce soit le venin cytotoxique, hémotoxique ou neurotoxique, ils comportent tous du phosphoestérases sécrétant les endonucléases qui hydrolysent les acides nucléiques ADN et ARN, en agissant elle obtient un pH jusque 9 ou 10, tandis que les phosphoestérases coupent les liaisons séparant l’oxygène du ribose (en position 3’) ou du désoxyribose afin de les séparer du phosphore, de même pour les liaisons en position 5’ (voir le schéma ci-contre).
- L-amino-acide-oxydase
 L-amino-acide-oxydase
L-amino-acide-oxydase
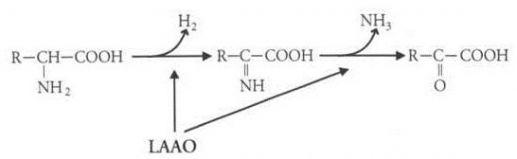
L-amino-acide-oxydase est une enzyme qui est responsable d’un déclanchement de désamination et d’oxydation des acides aminés, celles-ci sont alors transformés en acide a-cétonique (voir la figure). Son poids moléculaire est de 85 kDa et peut atteindre jusqu’à 153 kDa. Cette enzyme représente à elle seule un pourcent de la toxicité totale du venin, cela s’explique par la faible concentration de cette-dernière.
- Hyaluronidase
 Hyaluronidase
Hyaluronidase
Comme le Phosphoestérases l’hyaluronidase est présente dans tous les venins. Elles hydrolysent les acides hyaluroniques ou bien le sulfate de chondroïtine eux responsable de la cohésion des tissus conjonctifs. Donc cette enzyme a été reconnue pour favoriser la propagation du venin.
- Enzymes lytiques diverses
Parmi ces enzymes décrites, il en reste plusieurs comme : l’amylase, des transaminases, des déshydrogénases dont son effet thérapeutiques et toxique sont négligeable pour les humains.
3) Toxines
Contrairement aux enzymes, les toxines sont des petits peptides ne dépassant pas plusieurs dizaines d’acides aminés et leurs poids moléculaire vari mais dépassent jamais 30 kDa. Les toxines se fixent sur les organismes cibles afin de créer des désordres pathologiques. Donc les toxines ont la faculté d’inhiber ou d’activer ces organismes cibles (récepteurs, transporteurs…).
Voici quelques toxines présentent dans le venin de serpent :
- Neurotoxines postsynaptiques
=>Les curarisantes sont des toxines qui bloquent l’influx nerveux sur les membranes postsynaptiques, en agissant immédiatement sur les récepteurs de l’acétylcholine, cette toxine est composée d’une seule chaîne de polypeptides c’est-à-dire entre 60 à 74 acides aminés. Son poids moléculaire peut varier entre 7 et 8 kDa, de plus elle est très rigide c’est à cause des ponts disulfures (voir schéma ci-contre).
Il en existe trois types :
Les neurotoxines-OC courtes : 60 à 62 acides aminés, 4 ponts disulfures.
Les neurotoxines-α longues : 66 à 74 acides aminés, 5 ponts disulfures.
Les neurotoxines-K : 66 à 70 acides aminés, 5 ponts disulfures.
Les neurotoxines-OC longues et neurotoxines-K : sont semblable à cause de leur grande homologie de structure mais font tout de même apparaître une différence comme leur composition en acides aminés. Ceci leur apporte certaines propriétés pharmacologiques un peu différentes, elles servent principalement dans la reconnaissance des récepteurs cholinergiques.
=>Les toxines muscariniques se reconnaissent par une dizaine de polypeptides de petite taille. Cette toxine est voisine à la neurotoxine curarisante. Son poids moléculaire s’élève en moyenne à 7.5 kDa (65 acides aminés pour 4 ponts disulfures).
- Cytotoxines
es cytotoxines appelé aussi cardiotoxines est composé d’une cinquantaine de polypeptides ce groupe est homogène en raison de la grande homologie de structure. Cette toxine est équivalent aux neurotoxines-α c’est-à-dire 60-65 acides aminés et 4 ponts disulfures. En retour cette toxine n’a aucun effet immunologique.
- Neurotoxines présynaptiques
Ces toxines présynaptiques peuvent être appelées neurotoxines-P (classée en trois groupes), formé de quatre sous-unités, cela dépend de leur origine. Les neurotoxines présynaptiques ont une fonction phospholipasique A2 (enzyme vu plus haut) indispensable à leur activité toxique. Une sous-unité élémentaire a été remarquée avec une chaîne de polypeptides de 120 acides aminés avec 6 à 8 ponts disulfures, de plus le poids moléculaire est compris entre 13 et 14 kDa.
=>Les neurotoxines-p sont des monocaténaires, elles présentent une séquence d’acide aminé équivalent à celle du phospholipases A2.
=>La β-bungarotoxine, formé en deux polypeptides reliés grâce à un pont disulfure. Cette toxine possède des sous-unités qui portent la fonction de phospholipasique possédant des acides aminés égale à la phospholipase pancréatique dont son poids moléculaire est de 13 kDa. Puis une deuxième sous-unité avec un poids moléculaire de 7 kDa alter ego de la dendrotoxine.
- Dendrotoxines
Autre fois cette toxine a été découverte dans le venin du Dendroaspis (mamba), encore aujourd’hui appelé toxines présynaptiques facilitatrices son poids moléculaire est de 6 à 7 kDa et pour finir composé de 57 à 65 acides aminés avec 3 pont disulfures. La dendrotoxines favorise donc la libération d’acétylcholine.
- Fasciculines
Comme la dendrotoxine, la fasciculines a été découvert puis isolé du venin du dendroaspis. Cette toxine est composée de polypeptides de 7 kDa, 60 ou 61 acides aminés et 4 ponts disulfures. Sa structure se rapproche fortement au toxine-α ainsi que les cytotoxines. Enfin les fasciculines sont des inhibiteurs de l’acétylcholinestérase.
- Myotoxines
Peptides de 42 à 45 acides aminés qui obtiennent un poids moléculaire de 5 kDa avec 3 ponts disulfures, cette toxine ne possède aucune activité enzymatique. Les Myotoxines sont généralement rencontré dans le venin du Crotalus, elles agissent sur les canaux ioniques des cellules musculaires.
- Sarafotoxines
Les sarafotoxines sont des peptides formés d’une vingtaine d’acides aminés et 2 ponts disulfures, son poids moléculaires est de 2.5 kDa. En action cette toxine est similaire aux endothélines c’est une hormone présentes dans les cellules endothéliales des mammifères.
- Désintégrines
Cette toxine a été trouvée chez les viperidae, composé de peptides avec un poids moléculaire de 5 à 15 kDa elles possèdent 49 à 84 acides aminés puis 4 à 7 ponts disulfures.



